2023年11月7日,英国上市公司官网365张立新研究团队与南方科技大学/清华大学隋森芳研究组合作在Molecular Plant在线发表了题为“Regulatory dynamics of higher plant PSI-LHCI supercomplex during state transitions”的研究论文。
在自然环境中,一直变化的光照条件会影响光合作用的正常运转,使植物的实际光化学效率下降,甚至造成光损伤。为维持光合作用高效运行,植物在演化过程中形成了多种短期和长期的适应机制,既可以在光强较弱时帮助植物增强光能吸收以提高光合效率,也可以在强光或剧烈变化光照条件下通过各类响应机制减少光系统复合物的光损伤。因此,研究在不断变化的自然光照条件中高等植物的光适应分子机理不仅在理论研究上还是在生产实践上都具有十分重要的意义。状态转换(State transition, ST)就是其中一种光适应机制。当光系统II复合物(photosystem II, PSII)相对于光系统I复合物(photosystem I, PSI)受激发时(如蓝光),捕光天线蛋白LHCII (light-harvesting complex II)被磷酸化,磷酸化后的LHCII脱离PSII并与PSI结合(称为状态2,ST2)。相反,在PSI相对于PSII受激发时(如远红光),促进LHCII的去磷酸化,后者从PSI上解离并与PSII重新结合(称为状态1,ST1)。之前已经有报道在状态2下的玉米和绿藻的PSI-LHCI-LHCII的冷冻电镜结构(Pan et al.,2018; Huang et al.,2021; Pan et al.,2021)。然而,除了LHCII的可逆结合外,状态转换过程中高等植物PSI-LHCI自身是否会发生构想变化以适应光照条件的变化呢?同时,LHCII的动态结合及其可能的调控机制又是什么呢?

研究人员通过不同光照条件分别诱导得到状态1和状态2的拟南芥材料,利用活性胶-凝胶过滤层析纯化相关复合物,并使用单颗粒冷冻电镜解析得到PSI-LHCI-ST1和PSI-LHCI-LHCII-ST2的结构(Fig.1)。
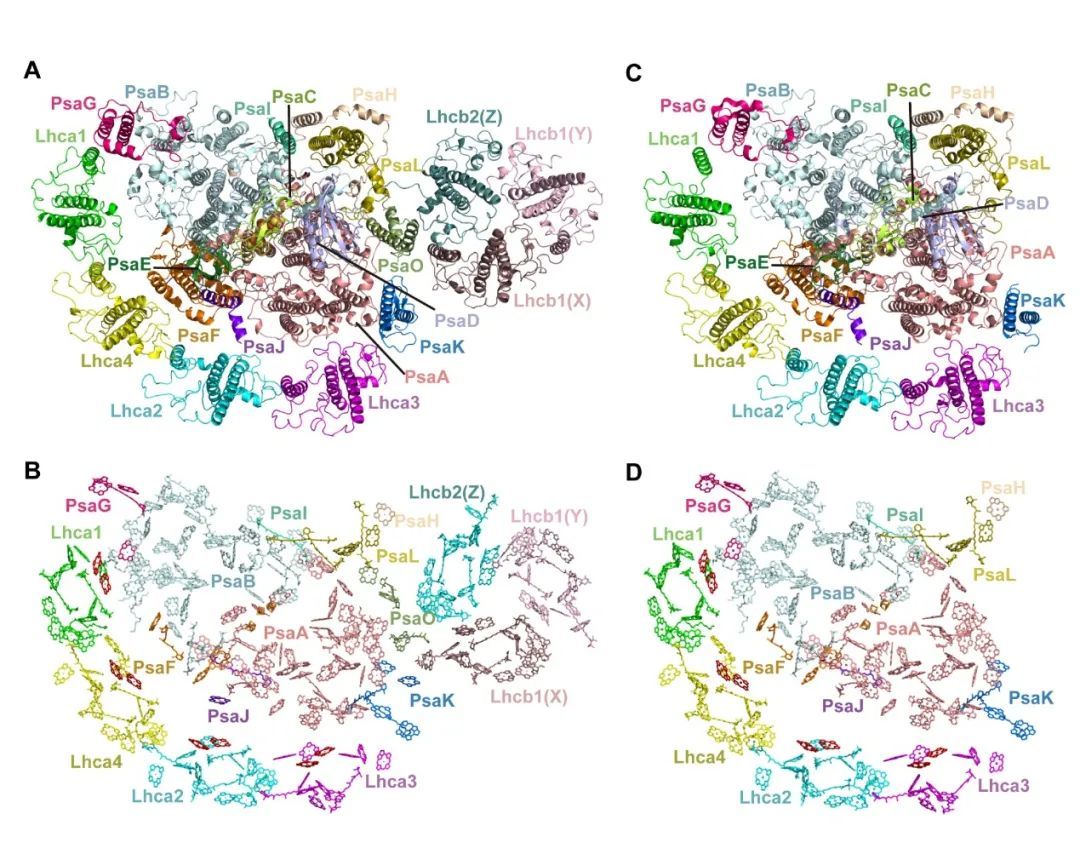
在结构分析的基础上,进一步结合突变体遗传分析和生理功能验证发现,PsaK作为LHCII新的停驻位点,通过与Lhcb1的相互作用促进了LHCII三聚体与PSI核心复合物的结合;同时,PsaL/PsaK/PsaA等亚基的构象变化增强了PsaO在状态2下与PSI的结合,进一步稳定LHCII三聚体(Fig.2)。
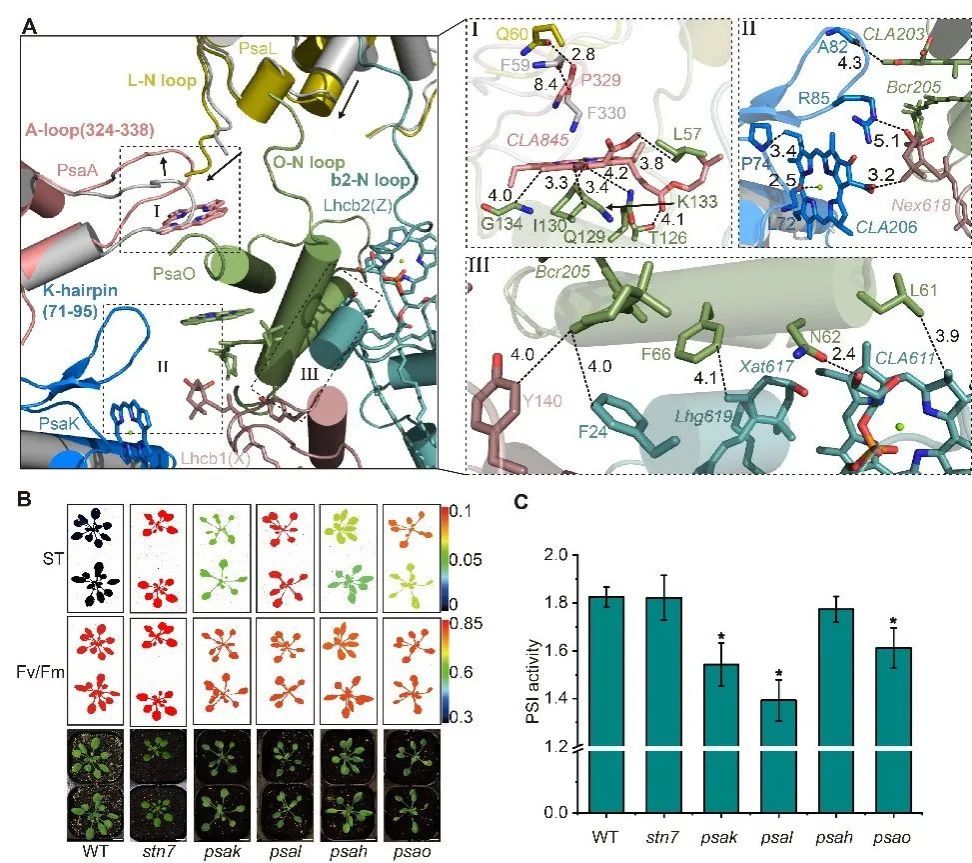
Fig. 2状态转换过程中PsaA/PsaL/PsaK的构象变化增强Psao和LHCII的结合。A.两种状态(ST2彩色,ST1灰色)下PsaA/PsaL/PsaK与PsaO/Lhcb2/Lhcb1交界面残基的构象变化。B.拟南芥突变体的叶绿素荧光分析。C.拟南芥突变体的PSI活性分析。
将两种状态下的光系统I复合物结构进行对比发现,PSI-LHCI在状态2时具有更紧凑的构象,且LHCI中多数叶绿素对之间的Mg-to-Mg距离更短,这增强了LHCI与PSI核心的相互作用,可能会提高外围捕光天线到PSI核心的能量传递效率。综上所述,基于两种状态下的冷冻电镜结构模型,结合突变体表型刻画和生理生化功能分析,该项工作揭示了一个进一步优化的PSI复合物参与状态转换的新模型,阐述了高等植物光适应的调控新机制,从而为提高作物光适应能力,改良作物品种提供了理论依据。英国上市公司官网365作物逆境适应与改良国家重点实验室/英国上市公司官网365的博士后吴江昊和南方科技大学/清华大学的博士陈帅嘉彬为该论文的共同第一作者。英国上市公司官网365作物逆境适应与改良国家重点实验室/英国上市公司官网365的张立新教授和南方科技大学/清华大学的隋森芳教授为该论文的共同通讯作者。该研究得到国家重点研发计划和国家自然科学基金的资助。



